

 |
 |

|
Промышленный лизинг
Методички
Кристаллиты графита и других веществ со слоистой структурой отличаются анизотропией геометрических размеров. Толщина t, измеряемая перпендикулярно к плоскости базиса {с - ось), меньше, чем длина L, измеряемая вдоль плоскости базиса (а -ось). Для графита «коэффициент формы» Lit может изменяться по крайней мере на порядок (приблизительно от 1 до 10). Если Lit > \ , то создаются условия для ориентации кристаллитов между скользящими поверхностями, что с теоретических позиций является идеальным для смазки. Высокая энергия связи между атомами углерода в кристаллической решетке графита обусловливает чрезвычайно высокую температуру плавления графита (3850 ± 50° С). Плотность графита составляет 2,21-2,25 г/см. Графит и графитовые материалы обладают малой химической активностью. Они стойки в большинстве кислот и щелочей, растворах солей и органических растворителях. Графит практически не вступает в химическое взаимодействие с веществами, воздействующими на него в направлении, перпендикулярном плоскости базиса. В направлении же вдоль плоскостей многие вещества могут внедряться в межплоскостное (межбазисное) пространство графита. При этом расстояние между плоскостями увеличивается. В промышленности применяют как натуральный графит, так и искусственный (синтетический). Графит, встречающийся в природе, как правило, содержит большое количество минеральных примесей. Руду для .превращения в технический графит подвергают обогащению. Искусственный графит получают нагреванием угля до 2200-2500° С в электрической печи. При этом происходит перекристаллизация (графитизация) угля и испарение зольных примесей. В результате можно получить очень чистый графит. Коллоидальные синтетические графиты отличаются большой удельной поверхностью, нередко превышающей 100 м/г. Способы измельчения графита разработаны давно. Графитовые коллоидные препараты выпускает фирма «Ачесон» (США) с 1904 г. В СССР такие препараты выпускаются Воскресенским химкомбинатом. Технология измельчения графита изложена в работе [62]. Максимальная рабочая температура, при которой графит может применяться в качестве твердой смазки, сильно зависит от внешних условий и режимов работы. При непрерывной работе порошкообразного графита на воздухе температура, при которой начинается интенсивное окисление, зависит от удельной поверхности, состава газообразной атмосферы и скорости подъемна температуры. Результаты термогравиметрического анализа порошка графита с удельной поверхностью 170 м/г в атмосфере сухого кислорода ири иовышении температуры со скоростью 3° С в минуту приведены на рис. 10 [91]. Изменение температуры окисления в сухом кислороде с увеличением удельной поверхности синтетического графита приведено на рис. 11 [91]. При увеличении удельной поверхности 28 80 60 «о го "С 800 300 т ьоо 600 t°c о . юо гоо т ш зоо mW Рис. 10. Зависимость потери массы от температуры: удельная поверхность 170 м/г, атмосфера - сухой кислород; скорость повышения температуры 3° С/мин; температура окисления 585° С Рис. 11. Зависимость температуры окисления синтетического графита от удельной поверхности (в атмосфере сухого кислорода) свыше 500 м/г начинается резкое снижение температуры окисления и порошок в конце концов становится пирофорным. Представления, высказанные еще В. Л. Брэггом, что относительно большое расстояние между плоскостями является результатом низкой адгезии между ними и что этим объясняется смазочное действие графита, чересчур упрощены. Оценочные значения энергии связи между слоями колеблются от 1 до 20 ккал/моль, по сравнению с 85 ккал/моль для связей между атомами в пределах каждой плоскости. Сила, необходимая для среза графита вдоль плоскостей базиса, зависит не только от прочности единичной связи, но и от количества одновременно разрушаемых связей. Срез одновременно по всем связям между плоскостями требует приложения очень больших сил и практически нереален. Соображения, основанные на рассмотрении энергии связи, свидетельствуют о том, что разделение кристаллитов по плоскости базиса в большинстве случаев происходит «раскалыванием» с края, ири котором одновременно разрушаются лишь несколько связей. Справедливость такой точки зрения подтверждается наблюдаемым влиянием внешней среды на смазочные свойства графита. П. Дж. Брайант и другие исследователи [91 ] измеряли энергию связи между слоями (плоскостями базиса) в кристаллитах графита в различных газовых атмосферах. Методика измерения заключалась в раскалывании кристалла графита по плоскости спайности (образовании начальной трещины). После того как система приходила в равновесие, в камеру медленно подавали газ. Если энергия связи при этом уменьшалась, то равновесие нарушалось и трещина распространялась далее. Энергия связи, измеренная в вакууме, составляла 1750 эрг/см- (6,6 ккал/моль), 0.5 О.Ч 0,3 0,2 0,1
/ 23456789 10 Рис. 12. Влияние газовой среды на коэффициент трения спектрально чистого графита: / - азот: 2 - кислород: Л - гептан; 4 - водород; 5 -пары воды; 6 - этиловый спирт ЧТО находится в хорошем соответствии с теоретическим значением, найденным на основе квантово-механических расчетов (2500 эрг/см или 9,4 ккал/моль) и на порядок выше, чем значения, полученные для графита в воздушной среде. Было установлено, что воздух, кислород и пары воды снижают энергию связи. Влияние кислорода обусловлено взаимодействием неспаренных электронов газовых молекул и я-электронов графита. Авторы пришли к заключению, что графит сам по себе не является хорошей сухой смазкой и лишь присутствие адсорбированных газов и паров приводит к снижению трения и износа графита. Влияние среды на трение графита исследовал Р. X. Сэвидж [73]. Он установил, что трение графита по графиту или металлу в вакууме, при тщательном обезжиривании и удалении адсорбированных газов высоко (/ до 0,8). Высокое трение сопровождается интенсивным изнашиванием даже в том случае, когда плоскость базиса расположена параллельно поверхности скольжения. Это привело Р. X. Сэвиджа в общем к правильному заключению, что для обеспечения смазочного действия графита необходимо уменьшить поверхностную энергию адсорбцией. Это представление распространяется им и на ненасыщенные валентные связи углерода у краев кристаллитов, возникшие при разрушении кристаллической решетки (дроблении кристаллов). В сравнительно недавней работе Г. В. Роу, изучавший в различных газовых атмосферах трение одноименных графитовых образцов [91] после предварительной их очистки прокаливанием в вакууме при температуре 1100° С, получил близкие описанным выше результаты. В вакууме коэффициент трения высокий (рис. 12), но при низких давлениях кислорода, паров воды и других легко конденсирующихся газов снижается до 0,15. Резкое повышение коэффициента трения графита в вакууме после прокаливания при высоких температурах наблюдалось 30 и в наших экспериментах [61 ]. Значение коэффициента трения при комнатной температуре составляло примерно 0,8. Повышение температуры выше 500° С приводило к постепенному снижению коэффициента трения до 0,2-0,15. Аналогичная картина наблюдалась и в инертных газовых средах. Это свидетельствует о большой роли адсорбционных слоев в обеспечении низкого трения при комнатной и невысоких температурах. При высоких температурах роль адсорбции снижается и низкое трение может быть объяснено ослаблением межплоскостных связей. Дж. Спредборо [97] с помощью электронного микроскопа обнаружил, что при скольжении медного ползуна по поверхности базиса естественного или синтетического графита происходит разделение слоев вследствие скола, и отделившиеся плоские частицы сворачиваются в ролики. Низкое трение графита он пытался объяснить тем, что ролики играют роль тел качения и при их образовании трение скольжения переходит в трение качения. С этих позиций повышение трения в вакууме Спредборо объясняет тем, что вследствие повышения энергии связи между слоями ролики не образуются. Эта гипотеза не подтвердилась. Для практического применения графита (а также и дисульфида молибдена) в качестве твердой смазки важен установленный факт [78], что лучшими антифрикционными свойствами обладают порошки, частицы которых имеют большую площадь по плоскости спайности и малую площадь полярных кромок (образующихся при разрушении частиц в процессе дробления перпендикулярно плоскостям спайности). Оптимальные свойства имеют порошки, полученные при дроблении на шаровой мельнице в среде rt-гептана. Дисульфид молибдена (MoSa), или молибденит, был известен еще древним грекам и его часто принимали за свинец или графит. Молибденит, являющийся основным сырьем для изготовления молибдена, добывается в очень больших количествах. Смазочные свойства дисульфида молибдена известны давно, но интенсивно применять его в качестве смазочного материала начали лишь в последние десятилетия [4, 5, 32, 62, 73, 78], В настоящее время природный дисульфид молибдена используют в качестве добавки к маслам и пластичным смазкам, как составную часть композиционных антифрикционных материалов (на основе полимеров и металлов), а также в виде поверхностных антифрикционных покрытий, отличающихся как применяемым связующим и добавками, так и способом нанесения. Кристаллы дисульфида молибдена имеют металлический блеск. Цвет его изменяется от синевато-черного до черного. Плотность MoSa составляет 4,8 г/см*, твердость по Моосу - 1,0-1,5. Электрическое сопротивление большое при низком напряжении и падает с увеличением напряжения. Появление проводимости в MoSa вызывается как нагре-ром проходящим током, так и действием самого электрического 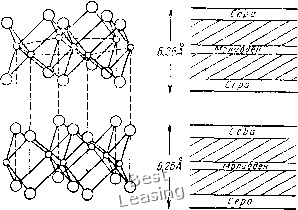 Рис. 13. Кристаллическая структура природного дисульфида молибдена (молибденита) ПОЛЯ, при температурах выше 850-900° С он становится хорошим проводником. Дисульфид молибдена MoSj во многом напоминает графит. Он также имеет слоистую гексагональную структуру (рис. 13), в которой связи между атомами молибдена и серы сравнительно короткие, а расстояния между слоями .серы - большие. Для синтетического дисульфида молибдена характерна ромбоэдрическая структура [91]. Углы между связями S-Мо-S свидетельствуют о их ковалент-ном характере. Энергия связи в слоях, содержащих единичные комплексы S-Мо-S, велика. Связь между соседними слоями атомов серы мала, поэтому кристаллы дисульфида молибдена легко расщепляются по плоскостям спайности. Поверхностная энергия этих плоскостей низкая. Кромки или торцы кристаллов имеют высокую иоверхностную энергию и в воздухе, по-видимому, легко вступают в реакцию (в первую очередь с кислородом). В этом случае состав кромок соответствует окислу молибдена, относительно стабильному в обычных условиях. Дисульфид молибдена обладает очень высокой радиационной стойкостью - каких либо изменений не наблюдается даже при дозе радиации 5-10 рад"[4]. Это позволяет применять его в условиях высокой искусственной или естественной радиации (атомная промышленность, космические исследования). Дисульфид молибдена химически мало активен. Он энергично реагирует с фтором, при нагревании реагирует с хлором, образуя MoClg, а с бромом практически во взаимодействие не вступает. Дисульфид молибдена растворяется в царской водке. Окисляется в контакте с горячей серной или азотной кислотами, образуя окисел М0О3. При высоких Рис. 14. Зависимость потери массы порошка % дисульфида молибдена от температуры, удель-ная поверхность 3,7 мг; атмосфера - сухой кислород; скорость повышения температуры 3° С/мин; температура окисления 298° С • температурах водород может восста- д навливать M0S2 до чистого металла без образования каких-либо промежуточных соединений. * В вакууме и инертных газовых средах дисульфид молибдена стаби- лен и обеспечивает низкое трение до температур 1100-1150° С. При нагреве на воздухе M0S2 окисляется 2 до М0О3 и серы или SO2- Считают, что образование окисных пленок начинается при температуре 350° С, а интенсивное окисление - ири температурах выше 480° С, однако первые изменения, заключающиеся в некотором увеличении массы образцов, наблюдаются уже при температуре 220° С [78]. Температура начала интенсивного окисления порошкообразного дисульфида молибдена на воздухе зависит от удельной поверхности. Результаты термогравиметрического анализа порошка дисульфида молибдена с удельной поверхностью 3,7 м/г в атмосфере сухого кислорода ири иовышении температуры со скоростью 3° С в минуту приведены на рис. 14 [91 ]. Температура окисления равна 298° С. Максимальное теоретическое изменение массы, равное 10,08%, соответствует реакции 2M0S2 + 702 = 2МрОз-f-+ 4SO2. Как и для графита, увеличение удельной иоверхности порошка дисульфида молибдена приводит к снижению температуры окисления. Однако достигаемые обычными способами размельчения значения удельной поверхности для дисульфида молибдена значительно меньше, чем для графита. В некоторых случаях найденная описанным способом температура окисления не определяет верхнего температурного предела, при котором может применяться твердая смазка, так как он зависит также от длительности работы и состава газовой атмосферы. Значения коэффициента трения и ири частичном окислении продолжают оставаться низкими при условии, если сохраняется непрерывная подиоверхностная пленка дисульфида молибдена, прочно связанная с подложкой. Поверхностная пленка трехокиси молибдена в этом случае не оказывает влияния на действие твердой смазки. В результате размельчения образуются агрегаты случайно ориентированных кристаллитов. Связи между частицами могут изменяться в широких пределах (от взаимодействия ненасыщенных 3 д. п. Семенов, Ю. Э. Савинскнй 33 0 1 2 3 [ 4 ] 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||